Tất cả
Hỏi bài tập Toán Học
Vật Lý
Hóa Học
Tiếng Anh
Ngữ Văn
Hỏi đời sống Tâm lý cảm xúc
Tình cảm
Gia đình bạn bè
Cơ thể & Dậy thì
Giải trí
Mạng xã hội
Định hướng cuộc sống
Hỏi đáp ẩn danh
Lingg Thùy
02/12/2025
giải hộ mik câu trg ảnh

 0
0
Trả lời câu hỏi của Lingg Thùy
-
Câu trả lời phải chính xác, đầy đủ dựa trên kiến thức xác thực:
- ✔ Đối với câu hỏi trắc nghiệm: Đưa đáp án lựa chọn + giải thích lý do chọn đáp án.
- ✔ Đối với câu hỏi tự luận: Đưa lời giải và đáp án cho câu hỏi.
- ✔ Đối với câu hỏi trả lời ngắn: Đưa ra đáp án + giải thích lý do.
- ✔ Chấp nhận sử dụng ảnh do thành viên viết tay, ảnh cần rõ nét, không bị mờ, vỡ ảnh.
- Sử dụng ngôn ngữ rõ ràng, dễ hiểu.
- Tránh đưa ra các ý kiến cá nhân mang tính chất chủ quan.
- Nếu sử dụng thông tin từ nguồn khác, phải trích dẫn nguồn đầy đủ và chính xác.
- Tuyệt đối không được sao chép các thông tin từ các trang khác, từ AI hoặc chatGPT.
CÂU TRẢ LỜI



Timi
02/12/2025
Trợ lý học tập AI - Câu trả lời này chỉ mang tính tham khảo
Để giải quyết bài toán, chúng ta cần thực hiện các bước tính toán cho từng phần và xác định tính đúng sai của từng nhận định.
### Phần 1: Tác dụng giữa acetic acid và ethylic alcohol
1. **Số mol CH₃COOH (acetic acid)**:
- Khối lượng acetic acid = 30 gam
- Khối lượng mol của CH₃COOH = 60 g/mol
- Số mol CH₃COOH = 30 g / 60 g/mol = 0,5 mol.
- **Nhận định a**: Đúng.
2. **Khối lượng ethyl acetate tạo thành theo lý thuyết**:
- Phương trình phản ứng:
\[
CH_3COOH + C_2H_5OH \xrightarrow{H_2SO_4} CH_3COOC_2H_5 + H_2O
\]
- Tỉ lệ phản ứng 1:1, nên 0,5 mol CH₃COOH sẽ tạo ra 0,5 mol CH₃COOC₂H₅.
- Khối lượng mol của CH₃COOC₂H₅ = 88 g/mol.
- Khối lượng ethyl acetate = 0,5 mol × 88 g/mol = 44 gam.
- **Nhận định b**: Đúng.
3. **Khối lượng ethyl acetate thực tế thu được với hiệu suất 60%**:
- Khối lượng thực tế = 44 g × 60% = 26,4 gam.
- **Nhận định c**: Đúng.
4. **Khối lượng ethyl acetate nếu chỉ có 0,25 mol CH₃COOH**:
- Khối lượng ethyl acetate = 0,25 mol × 88 g/mol = 22 gam.
- **Nhận định d**: Đúng.
### Phần 2: Tác dụng giữa acetic acid và Na
1. **Viết PTHH**:
- Phương trình phản ứng:
\[
2 CH_3COOH + 2 Na \rightarrow 2 CH_3COONa + H_2
\]
2. **Số mol CH₃COOH**:
- Khối lượng acetic acid = 18 gam.
- Số mol CH₃COOH = 18 g / 60 g/mol = 0,3 mol.
- **Nhận định a**: Đúng.
3. **Số mol H₂ thu được**:
- Từ 2 mol CH₃COOH sinh ra 1 mol H₂.
- Số mol H₂ từ 0,3 mol CH₃COOH = 0,3 mol / 2 = 0,15 mol.
- **Nhận định b**: Đúng.
4. **Thể tích khí H₂ thu được ở điều kiện chuẩn**:
- 1 mol khí H₂ có thể tích 22,4 lít.
- Thể tích H₂ = 0,15 mol × 22,4 lít/mol = 3,36 lít.
- **Nhận định c**: Sai (thể tích H₂ đúng là 3,36 lít, không phải 3,7185 lít).
5. **Nếu thay 18 gam CH₃COOH bằng 12 gam**:
- Số mol CH₃COOH mới = 12 g / 60 g/mol = 0,2 mol.
- Số mol H₂ thu được = 0,2 mol / 2 = 0,1 mol.
- Thể tích H₂ = 0,1 mol × 22,4 lít/mol = 2,24 lít.
- **Nhận định d**: Sai (thể tích H₂ đúng là 2,24 lít, không phải 2,479 lít).
### Kết luận:
- a. Đúng
- b. Đúng
- c. Sai
- d. Sai
### Tóm tắt:
Các nhận định đúng là a, b; các nhận định sai là c, d.
Hãy giúp mọi người biết câu trả lời này thế nào?
0/5 (0 đánh giá)
 0
0
0 bình luận
Bình luận
thaonguyen93
02/12/2025
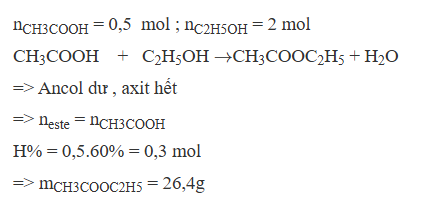
Hãy giúp mọi người biết câu trả lời này thế nào?
0/5 (0 đánh giá)
 0
0
0 bình luận
Bình luận
Nếu bạn muốn hỏi bài tập
Các câu hỏi của bạn luôn được giải đáp dưới 10 phút
CÂU HỎI LIÊN QUAN
Lingg Thùy
04/12/2025
hoàng bách
04/12/2025
Lingg Thùy
02/12/2025
Lingg Thùy
02/12/2025
Top thành viên trả lời
Chọn thời gian
Anastasiamila 810 Điểm
Brother 550 Điểm
Rowena Lilly Naila 460 Điểm
ngdepngutrongrung 310 Điểm
Trần Hữu Bảo Nam 280 Điểm
FQA.vn Nền tảng kết nối cộng đồng hỗ trợ giải bài tập học sinh trong khối K12. Sản phẩm được phát triển bởi CÔNG TY TNHH CÔNG NGHỆ GIA ĐÌNH (FTECH CO., LTD)
Điện thoại: 1900636019
Email: info@fqa.vn
 Địa chỉ: Số 21 Ngõ Giếng, Phố Đông Các, Phường Đống Đa, Thành phố Hà Nội, Việt Nam.
Địa chỉ: Số 21 Ngõ Giếng, Phố Đông Các, Phường Đống Đa, Thành phố Hà Nội, Việt Nam.
Người chịu trách nhiệm quản lý nội dung: Đào Trường Giang
Giấy phép thiết lập MXH số 07/GP-BTTTT do Bộ Thông tin và Truyền thông cấp ngày 05/01/2024
Copyright © 2023 fqa.vn All Rights Reserved



