Tất cả
Hỏi bài tập Toán Học
Vật Lý
Hóa Học
Tiếng Anh
Ngữ Văn
Hỏi đời sống Tâm lý cảm xúc
Tình cảm
Gia đình bạn bè
Cơ thể & Dậy thì
Giải trí
Mạng xã hội
Định hướng cuộc sống
Hỏi đáp ẩn danh
15/08/2024
Giải hộ mình câu này với các bạn

 0
0
-
Câu trả lời phải chính xác, đầy đủ dựa trên kiến thức xác thực:
- ✔ Đối với câu hỏi trắc nghiệm: Đưa đáp án lựa chọn + giải thích lý do chọn đáp án.
- ✔ Đối với câu hỏi tự luận: Đưa lời giải và đáp án cho câu hỏi.
- ✔ Đối với câu hỏi trả lời ngắn: Đưa ra đáp án + giải thích lý do.
- ✔ Chấp nhận sử dụng ảnh do thành viên viết tay, ảnh cần rõ nét, không bị mờ, vỡ ảnh.
- Sử dụng ngôn ngữ rõ ràng, dễ hiểu.
- Tránh đưa ra các ý kiến cá nhân mang tính chất chủ quan.
- Nếu sử dụng thông tin từ nguồn khác, phải trích dẫn nguồn đầy đủ và chính xác.
- Tuyệt đối không được sao chép các thông tin từ các trang khác, từ AI hoặc chatGPT.



15/08/2024
 0
0
15/08/2024
Câu 2:
a. pKa của p-hydroxybenzoic acid: 4,54
pKa của m-hydroxybenzoic acid: 4,06
pKa của o-hydroxybenzoic acid: 2,97
b. * Tính acid của p-hydroxybenzoic acid:
Ở dạng base liên hợp p-hydroxybenzoate, nhóm HO đẩy electron về nguyên tử carbon liên kết trực tiếp với nhóm COO- theo hiệu ứng liên hợp (+C) làm tăng tương tác đẩy tĩnh điện giữa hai trung tâm điện âm gần nhau. Mặt khác hiệu ứng cảm ứng hút electron (-I) của nhóm OH lại yếu vì ở xa nhóm COO- khiến cho base liên hợp này không được bền hóa nhiều bởi hiệu ứng –I

=> p-hydroxybenzoic acid có tính acid yếu hơn benzoic acid và yếu nhất trong số 3 đồng phân
* Tính acid của m-hydroxybenzoic acid:
Ở dạng base liên hợp m-hydroxybenzoate, nhóm HO không đẩy electron về nguyên tử carbon liên kết trực tiếp với nhóm COO- như trường hợp base liên hợp p-hydroxybenzoate, dẫn đến base liên hợp này không bị giảm độ bền bởi tương tác đẩy tĩnh điện nhiều như với trường hợp đồng phân p. Đồng thời, hiệu ứng cảm ứng hút electron (-I) của liên keets C – O(H) phenol ở gần nhóm COO- hơn so với đồng phân p góp phần làm giải tỏa bớt điện tích âm trong hệ m-hydroxybenzoate
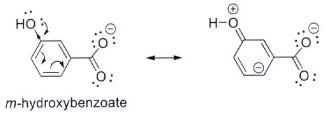
=> m-hydroxybenzoic acid có tính acid mạnh hơn benzoic acid
* Tính acid của o-hydroxybenzoic acid:
Ở dạng base liên hợp o-hydroxybenzoate, hiệu ứng liên hợp (+C) của nhóm OH làm giảm bền hệ benzoate tương tự như đồng phân p. Tuy nhiên nhóm OH lại có hiệu ứng cảm ứng hút electron (-I) mạnh hơn do ở gần với nhóm COO- hơn so với hai đồng phân còn lại và đặc biệt tạo liên kết hydrogen nội phân tử với nhóm COO- làm bền hóa dạng base liên hợp này hơn

=> o-hydroxybenzoic acid có tính acid mạnh hơn benzoic acid và mạnh nhất trong số 3 đồng phân
 0
0
Nếu bạn muốn hỏi bài tập
Các câu hỏi của bạn luôn được giải đáp dưới 10 phút
CÂU HỎI LIÊN QUAN
26/07/2025
Top thành viên trả lời








