Tất cả
Hỏi bài tập Toán Học
Vật Lý
Hóa Học
Tiếng Anh
Ngữ Văn
Hỏi đời sống Tâm lý cảm xúc
Tình cảm
Gia đình bạn bè
Cơ thể & Dậy thì
Giải trí
Mạng xã hội
Định hướng cuộc sống
Hỏi đáp ẩn danh
Giải thích sự hình thành liên kết và góc liên kết trong các phân tử: NH3, CH4,H2O
 0
0
-
Câu trả lời phải chính xác, đầy đủ dựa trên kiến thức xác thực:
- ✔ Đối với câu hỏi trắc nghiệm: Đưa đáp án lựa chọn + giải thích lý do chọn đáp án.
- ✔ Đối với câu hỏi tự luận: Đưa lời giải và đáp án cho câu hỏi.
- ✔ Đối với câu hỏi trả lời ngắn: Đưa ra đáp án + giải thích lý do.
- ✔ Chấp nhận sử dụng ảnh do thành viên viết tay, ảnh cần rõ nét, không bị mờ, vỡ ảnh.
- Sử dụng ngôn ngữ rõ ràng, dễ hiểu.
- Tránh đưa ra các ý kiến cá nhân mang tính chất chủ quan.
- Nếu sử dụng thông tin từ nguồn khác, phải trích dẫn nguồn đầy đủ và chính xác.
- Tuyệt đối không được sao chép các thông tin từ các trang khác, từ AI hoặc chatGPT.



07/10/2024
 0
0
07/10/2024
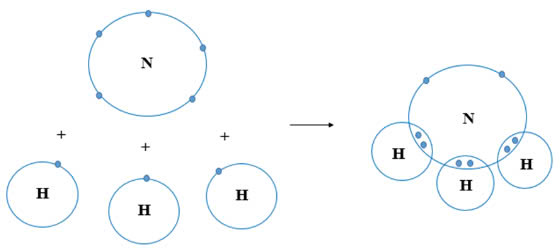
* Sự hình thành liên kết trong NH3:
- Nguyên tử nitrogen (N) có cấu hình electron là 1s22s22p3. Để đạt được cấu hình giống khí hiếm, nguyên tử N cần thêm 3 electron.
- Nguyên tử hydrogen (H) có cấu hình electron là 1s1. Để đạt được cấu hình giống khí hiếm, nguyên tử H cần thêm 1 electron.
- Để tạo thành liên kết trong phân tử NH3, mỗi nguyên tử H góp chung 1 electron với nguyên tử N tạo thành 3 cặp electron dùng chung.
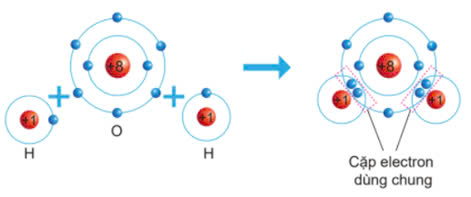
* Sự hình thành liên kết trong H2O
- Nguyên tử O (Z = 8): 1s22s22p4 => Có 6 electron lớp ngoài cùng => Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (Z = 1): 1s1 => Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
=> Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
 0
0
07/10/2024
Phân tử CH4 không có cặp liên kết, dnagj hình học phân tử là tứ diện đều, các góc ∠HCH = 109,50. Phân tử NH3 có 1 cặp electron không liên kết trên nguyên tử N do đó phân tử NH3 chịu tác dụng của lực đẩy của cặp e chưa tham gia liên kết làm cho ∠HCH > ∠HNH. Tương tự, phân tử H2O có hai cặp electron không tham gia liên kết nên ∠HNH > ∠HOH
Các giá trị thực nghiệm
 0
0
07/10/2024
@cinamoll
1. Phân tử NH₃ (Amoniac):
- Sự hình thành liên kết: Phân tử NH₃ gồm một nguyên tử Nitơ (N) và ba nguyên tử Hydro (H). Nguyên tử N có 5 electron ở lớp ngoài cùng, cần thêm 3 electron để đạt cấu hình bền vững (giống khí hiếm). Mỗi nguyên tử H cung cấp 1 electron để tạo liên kết cộng hóa trị với nguyên tử N. Như vậy, có 3 liên kết cộng hóa trị giữa N và 3 nguyên tử H.
- Góc liên kết: Phân tử NH₃ có dạng hình chóp tam giác với một cặp electron tự do ở trên nguyên tử N. Cặp electron này đẩy các liên kết N-H xuống, tạo ra góc liên kết khoảng 107° giữa các nguyên tử H.
2. Phân tử CH₄ (Metan):
- Sự hình thành liên kết: Phân tử CH₄ gồm một nguyên tử Carbon (C) và bốn nguyên tử Hydro (H). Nguyên tử C có 4 electron ở lớp ngoài cùng, cần thêm 4 electron để đạt cấu hình bền vững. Mỗi nguyên tử H cung cấp 1 electron, tạo 4 liên kết cộng hóa trị giữa C và H.
- Góc liên kết: Phân tử CH₄ có cấu trúc tứ diện đều, trong đó nguyên tử C ở trung tâm và 4 nguyên tử H ở các đỉnh. Góc liên kết H-C-H là 109,5°.
3. Phân tử H₂O (Nước):
- Sự hình thành liên kết: Phân tử H₂O gồm một nguyên tử Oxi (O) và hai nguyên tử Hydro (H). Oxi có 6 electron ở lớp ngoài cùng, cần thêm 2 electron để đạt cấu hình bền vững. Mỗi nguyên tử H cung cấp 1 electron, tạo 2 liên kết cộng hóa trị với nguyên tử O.
- Góc liên kết: Phân tử H₂O có dạng góc với hai cặp electron tự do trên nguyên tử O. Những cặp electron này đẩy các liên kết O-H, làm cho góc liên kết giữa hai nguyên tử H là khoảng 104,5°.
Tổng kết:
- NH₃: Góc liên kết khoảng 107° (do ảnh hưởng của cặp electron tự do trên N).
- CH₄: Góc liên kết 109,5° (dạng tứ diện đều).
- H₂O: Góc liên kết khoảng 104,5° (do hai cặp electron tự do trên O).
 3
3
Nếu bạn muốn hỏi bài tập
Các câu hỏi của bạn luôn được giải đáp dưới 10 phút
CÂU HỎI LIÊN QUAN
15/12/2025
15/12/2025
15/12/2025
Top thành viên trả lời



