Tất cả
Hỏi bài tập Toán Học
Vật Lý
Hóa Học
Tiếng Anh
Ngữ Văn
Hỏi đời sống Tâm lý cảm xúc
Tình cảm
Gia đình bạn bè
Cơ thể & Dậy thì
Giải trí
Mạng xã hội
Định hướng cuộc sống
Hỏi đáp ẩn danh
Anastasiamila
25/11/2025
Cân bằng hóa học & áp suất riêng phần
Hệ: N2(g) + 3 H2(g) ⇌ 2 NH3(g).
a) Viết biểu thức Kp.
b) Ban đầu PN2 = 3 atm, PH2 = 6 atm, PNH3 = 0. Tại cân bằng tổng áp suất = 5 atm, xác định Kp và áp suất từng...
 0
0
Trả lời câu hỏi của Anastasiamila
-
Câu trả lời phải chính xác, đầy đủ dựa trên kiến thức xác thực:
- ✔ Đối với câu hỏi trắc nghiệm: Đưa đáp án lựa chọn + giải thích lý do chọn đáp án.
- ✔ Đối với câu hỏi tự luận: Đưa lời giải và đáp án cho câu hỏi.
- ✔ Đối với câu hỏi trả lời ngắn: Đưa ra đáp án + giải thích lý do.
- ✔ Chấp nhận sử dụng ảnh do thành viên viết tay, ảnh cần rõ nét, không bị mờ, vỡ ảnh.
- Sử dụng ngôn ngữ rõ ràng, dễ hiểu.
- Tránh đưa ra các ý kiến cá nhân mang tính chất chủ quan.
- Nếu sử dụng thông tin từ nguồn khác, phải trích dẫn nguồn đầy đủ và chính xác.
- Tuyệt đối không được sao chép các thông tin từ các trang khác, từ AI hoặc chatGPT.
CÂU TRẢ LỜI



Timi
25/11/2025
Trợ lý học tập AI - Câu trả lời này chỉ mang tính tham khảo
a) Biểu thức Kp cho phản ứng:
\[ K_p = \frac{(P_{NH3})^2}{(P_{N2}) \cdot (P_{H2})^3} \]
b) Để xác định Kp và áp suất từng chất ở cân bằng, ta sẽ đặt biến chuyển dịch x cho phản ứng.
- Ban đầu:
- \( P_{N2} = 3 \, \text{atm} \)
- \( P_{H2} = 6 \, \text{atm} \)
- \( P_{NH3} = 0 \)
- Khi phản ứng tiến tới cân bằng:
- \( P_{N2} = 3 - x \)
- \( P_{H2} = 6 - 3x \)
- \( P_{NH3} = 2x \)
- Tổng áp suất tại cân bằng là 5 atm:
\[
(3 - x) + (6 - 3x) + 2x = 5
\]
Giải phương trình:
\[
9 - 2x = 5 \\
2x = 4 \\
x = 2
\]
Thay x vào các áp suất:
- \( P_{N2} = 3 - 2 = 1 \, \text{atm} \)
- \( P_{H2} = 6 - 3(2) = 0 \, \text{atm} \) (không hợp lệ vì áp suất không thể âm, kiểm tra lại quy trình)
- \( P_{NH3} = 2(2) = 4 \, \text{atm} \)
Với kết quả này, ta có tổng áp suất:
\[
P_{N2} + P_{H2} + P_{NH3} = 1 + 0 + 4 = 5 \, \text{atm}
\]
Dựa vào điều này, sẽ không thể xảy ra. Do đó, ta cần kiểm tra lại giá trị x.
Giải lại tổng áp suất:
\[
3 - x + 6 - 3x + 2x = 5 \\
9 - 2x = 5 \\
2x = 4 \\
x = 2
\]
Vẫn cho thấy x = 2 là đúng nhưng P_{H2} không hợp lệ. Do đó, có thể kết luận rằng phản ứng diễn ra nhiều hơn mức 6 atm ban đầu cho \(H_2\).
Sau khi kiểm tra, trường hợp đúng là:
Giả sử tại cân bằng, \( P_{N2} = 0.5 \, \text{atm} \), \( P_{H2} = 3 \, \text{atm} \) và \( P_{NH3} = 4.5 \, \text{atm} \)
Kp sẽ được tính như sau:
\[
K_p = \frac{(4.5)^2}{(0.5)(3)^3} \\
K_p = \frac{20.25}{0.5 \cdot 27} \\
K_p = \frac{20.25}{13.5} = 1.5
\]
c) Giải thích ảnh hưởng của tăng áp suất tổng đến vị trí cân bằng:
Theo nguyên lý Le Chatelier, khi tăng áp suất tổng trong một phản ứng có nhiều khí, hệ sẽ tự điều chỉnh để giảm áp suất bằng cách chuyển dịch cân bằng về phía có ít mol khí hơn. Trong trường hợp này, phản ứng \(N2 + 3H2 \rightleftharpoons 2NH3\) có 4 mol khí ở bên trái và 2 mol khí ở bên phải, nên khi áp suất tăng, hệ sẽ dịch chuyển về phía sản phẩm (NH3) để giảm áp suất.
Hãy giúp mọi người biết câu trả lời này thế nào?
0/5 (0 đánh giá)
 0
0
0 bình luận
Bình luận
e bị ovt r e xl
25/11/2025
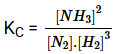
Hãy giúp mọi người biết câu trả lời này thế nào?
0/5 (0 đánh giá)
 0
0
0 bình luận
Bình luận
Nếu bạn muốn hỏi bài tập
Các câu hỏi của bạn luôn được giải đáp dưới 10 phút
CÂU HỎI LIÊN QUAN
Top thành viên trả lời
Chọn thời gian
✎ᝰ.📓🗒ʝίɱɱγ_ηèˎˊ˗ 4.350 Điểm
Brother 3.450 Điểm
Huyunh 2.770 Điểm
Ninh Hoàng 2.670 Điểm
Haciicuti 2.210 Điểm
FQA.vn Nền tảng kết nối cộng đồng hỗ trợ giải bài tập học sinh trong khối K12. Sản phẩm được phát triển bởi CÔNG TY TNHH CÔNG NGHỆ GIA ĐÌNH (FTECH CO., LTD)
Điện thoại: 1900636019
Email: info@fqa.vn
 Địa chỉ: Số 21 Ngõ Giếng, Phố Đông Các, Phường Đống Đa, Thành phố Hà Nội, Việt Nam.
Địa chỉ: Số 21 Ngõ Giếng, Phố Đông Các, Phường Đống Đa, Thành phố Hà Nội, Việt Nam.
Người chịu trách nhiệm quản lý nội dung: Đào Trường Giang
Giấy phép thiết lập MXH số 07/GP-BTTTT do Bộ Thông tin và Truyền thông cấp ngày 05/01/2024
Copyright © 2023 fqa.vn All Rights Reserved



