Tất cả
Hỏi bài tập Toán Học
Vật Lý
Hóa Học
Tiếng Anh
Ngữ Văn
Hỏi đời sống Tâm lý cảm xúc
Tình cảm
Gia đình bạn bè
Cơ thể & Dậy thì
Giải trí
Mạng xã hội
Định hướng cuộc sống
Hỏi đáp ẩn danh
02/09/2025
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng t...
 0
0
-
Câu trả lời phải chính xác, đầy đủ dựa trên kiến thức xác thực:
- ✔ Đối với câu hỏi trắc nghiệm: Đưa đáp án lựa chọn + giải thích lý do chọn đáp án.
- ✔ Đối với câu hỏi tự luận: Đưa lời giải và đáp án cho câu hỏi.
- ✔ Đối với câu hỏi trả lời ngắn: Đưa ra đáp án + giải thích lý do.
- ✔ Chấp nhận sử dụng ảnh do thành viên viết tay, ảnh cần rõ nét, không bị mờ, vỡ ảnh.
- Sử dụng ngôn ngữ rõ ràng, dễ hiểu.
- Tránh đưa ra các ý kiến cá nhân mang tính chất chủ quan.
- Nếu sử dụng thông tin từ nguồn khác, phải trích dẫn nguồn đầy đủ và chính xác.
- Tuyệt đối không được sao chép các thông tin từ các trang khác, từ AI hoặc chatGPT.



02/09/2025
 0
0
02/09/2025
$n_{MnO_2}= \dfrac{69,6}{86,94} ≈0,8 (mol)$
Phương trình hóa học:
$MnO_2+4HCl→MnCl_2+Cl2+2H_2O (1)$
Theo phương trình (1), ta có:
$n_{MnO_2}= n_{ Cl_2} = 0,8006 (mol) $
$Cl_2+2NaOH→NaCl+NaClO+H_2O (2)$
Theo phương trình (2), ta có:
$n_{NaOH} = 2n_{Cl_2} = 1.6 (mol)$
Theo đề, ta có: $n_{NaOH \ ban \ đầu} =0,5. 4=2 (mol)$
$\to n_{NaOH \ dư} =2 - 1.6 =0,4 (mol)$
Theo phương trình (2), ta có:
$n_{NaCl} = n_{NaClO} = n_{Cl_2} = ( 0.8) mol$
$\to C_{NaOH} = \dfrac{0,4}{0,5} = 0,8M$
$\to C_{NaCl} = \dfrac{0,8}{0,5} = 1,6M$
$\to C_{NaOH} = \dfrac{0,8}{0,5} = 1,6M$
 0
0
02/09/2025
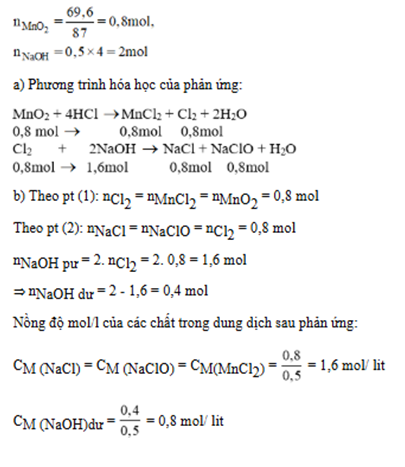
 0
0
02/09/2025
Bạn xem bài làm trong ảnh.
 0
0
Nếu bạn muốn hỏi bài tập
Các câu hỏi của bạn luôn được giải đáp dưới 10 phút
CÂU HỎI LIÊN QUAN
Top thành viên trả lời







