Số nguyên tố trong chu kì 3 của bảng tuần hoàn các nguyên tố hóa học là bao nhiêu? Cùng tìm hiểu một số thông tin cơ bản nhất về các nguyên tố trong chu kỳ 3 với những chia sẻ trong bài viết này của Admin các em nhé!
Số nguyên tố trong chu kì 3 của bảng tuần hoàn các nguyên tố hóa học là bao nhiêu?
Trong chu kì 3 của bảng tuần hoàn hóa học có tất cả 8 nguyên tố bao gồm: Na (Sodium), Mg (Magnesium), Al (Aluminium), Si (Silicon), P (Phosphorus), S (Sulfur), Cl (Chlorine), Ar (Argon). Tất cả các nguyên tố trong chu kỳ 3 đều có số lớp electron trong nguyên tử là 3. Số hiệu của nguyên tử trong từ Na đến Ar tăng dần từ 11 cho đến 18 tương ứng với đố là số electron ở lớp ngoài cùng tăng dần từ 1e đến 8e.

Thông tin cơ bản của 8 nguyên tố trong chu kỳ 3 của bảng tuần hoàn hóa học
Nguyên tố Na (Natri)

Ký hiệu hóa học: Na
Tên Latin: Sodium
Số hiệu nguyên tử: 11
Chu kỳ: 3
Nhóm nguyên tố: Kim loại kiềm
Nguyên tử khối tương đối: 22,98768
Nhóm: IA
Độ âm điện: 0,9
Số oxi hóa: +1
Cấu hình electron:
Khối lượng riêng []: 0,9725
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 98,81
Nhiệt độ sôi [°C]: 882,9
Điểm tới hạn [°C]: 2300
Áp suất tới hạn [MPa]: 35
Bán kính nguyên tử [pm]: 190
Bán kính cộng hóa trị [pm]: 154
Độ dẫn điện []: 141
Nhiệt dung riêng []: 1,23
Thời điểm khám phá: Năm 1807
Độ cứng (Theo thang Mohs): 0,4
Độ cứng theo thang đo Brinell: 0,69
Mô đun Young [GPa]: 10
Điện dẫn suất []:
Mô đun cắt [GPa]: 3,3
Năng lượng ion hóa bậc 1 [eV]: 5,1391
Năng lượng ion hóa bậc 2 [eV]: 47,286
Năng lượng ion hóa bậc 3 [eV]: 71,641
Đồng vị bền: 1
Đồng vị không bền: 6
Nguyên tố Mg (Magie)

Ký hiệu hóa học: Mg
Tên Latin: Magnesium
Số hiệu nguyên tử: 12
Chu kỳ: 3
Nhóm nguyên tố: Kim loại kiềm thổ
Nguyên tử khối tương đối: 24,3050
Nhóm: IIA
Độ âm điện: 1,2
Số oxi hóa: +2
Cấu hình electron:
Khối lượng riêng []: 1,735
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 648,8
Nhiệt độ sôi [°C]: 1090
Bán kính nguyên tử [pm]: 145
Bán kính cộng hóa trị [pm]: 130
Độ dẫn điện []: 156
Nhiệt dung riêng []: 1,02
Thời điểm khám phá: Năm 1808
Độ cứng (Theo thang Mohs): 2,25
Độ cứng theo thang đo Brinell: 260
Mô đun Young [GPa]: 45
Điện dẫn suất []:
Mô đun cắt [GPa]: 17
Năng lượng ion hóa bậc 1 [eV]: 7,6462
Năng lượng ion hóa bậc 2 [eV]: 15,035
Năng lượng ion hóa bậc 3 [eV]: 80,143
Đồng vị bền: 3
Đồng vị không bền: 5
Nguyên tố Al (Nhôm)

Ký hiệu hóa học: Al
Tên Latin: Aluminium
Số hiệu nguyên tử: 13
Chu kỳ: 3
Nhóm nguyên tố: Kim loại
Nguyên tử khối tương đối: 26,981539
Nhóm: IIIA
Độ âm điện: 1,5
Số oxi hóa: +3
Cấu hình electron:
Khối lượng riêng []: 2,6989
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 660,37
Nhiệt độ sôi [°C]: 2467
Bán kính nguyên tử [pm]: 118
Bán kính cộng hóa trị [pm]: 118
Độ dẫn điện []: 237
Nhiệt dung riêng []: 0,9
Thời điểm khám phá: Năm 1825
Độ cứng theo thang đo Vickers [MPa]: 167
Độ cứng theo thang đo Brinell: 245
Mô đun Young [GPa]: 70
Điện dẫn suất []:
Điện trở suất []: 0,0267
Mô đun cắt [GPa]: 26
Năng lượng ion hóa bậc 1 [eV]: 5,9858
Năng lượng ion hóa bậc 2 [eV]: 18,828
Năng lượng ion hóa bậc 3 [eV]: 28,447
Đồng vị bền: 1
Đồng vị không bền: 7
Nguyên tố Si (Silic)

Ký hiệu hóa học: Si
Tên Latin: Silicon
Số hiệu nguyên tử: 14
Chu kỳ: 3
Nhóm nguyên tố: Á kim
Nguyên tử khối tương đối: 28,0855
Nhóm: IVA
Độ âm điện: 1,8
Số oxi hóa: -4, +4
Cấu hình electron:
Khối lượng riêng []: 2,332
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 1410
Nhiệt độ sôi [°C]: 2355
Bán kính nguyên tử [pm]: 111
Bán kính cộng hóa trị [pm]: 111
Độ dẫn điện []: 148
Nhiệt dung riêng []: 0,70
Thời điểm khám phá: Năm 1824
Độ cứng (Theo thang Mohs): 7,0
Mô đun Young [GPa]: 47
Điện dẫn suất []:
Năng lượng ion hóa bậc 1 [eV]: 8,1517
Năng lượng ion hóa bậc 2 [eV]: 16,345
Năng lượng ion hóa bậc 3 [eV]: 33,492
Đồng vị bền: 3
Đồng vị không bền: 5
Nguyên tố P (Photpho)
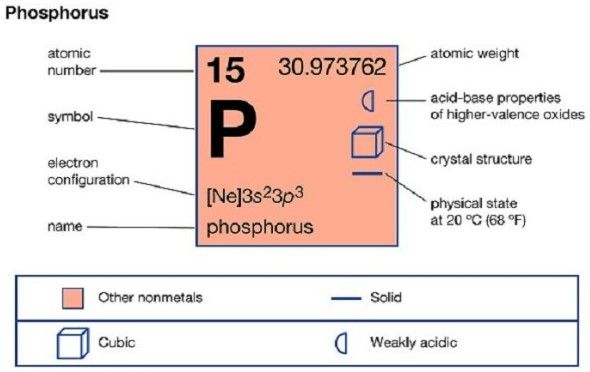
Ký hiệu hóa học: P
Tên Latin: Phosphorus
Số hiệu nguyên tử: 15
Chu kỳ: 3
Nhóm nguyên tố: Phi kim
Nguyên tử khối tương đối: 30,973762
Nhóm: VA
Độ âm điện: 2,1
Số oxi hóa: -3, +3, +5
Cấu hình electron:
Khối lượng riêng []: 1,83
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 44,1
Nhiệt độ sôi [°C]: 280
Bán kính nguyên tử [pm]: 98
Bán kính cộng hóa trị [pm]: 106
Độ dẫn điện []: 0,235
Nhiệt dung riêng []: 0,769
Thời điểm khám phá: Năm 1669
Điện dẫn suất []:
Năng lượng ion hóa bậc 1 [eV]: 10,4867
Năng lượng ion hóa bậc 2 [eV]: 19,725
Năng lượng ion hóa bậc 3 [eV]: 30,18
Đồng vị bền: 1
Đồng vị không bền: 6
Nguyên tố S (Lưu huỳnh)
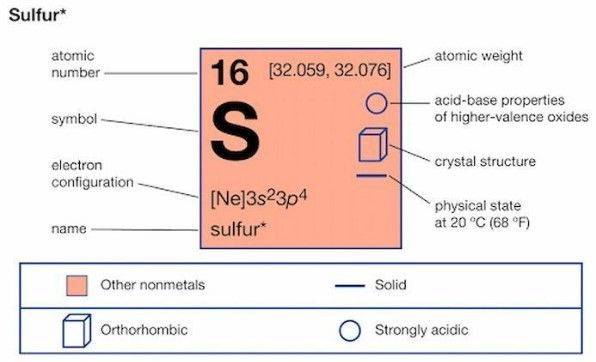
Ký hiệu hóa học: S
Tên Latin: Sulfur
Số hiệu nguyên tử: 16
Chu kỳ: 3
Nhóm nguyên tố: Phi kim
Nguyên tử khối tương đối: 32,066
Nhóm: VIA
Độ âm điện: 2,5
Số oxi hóa: -2, +2, +4, +6
Cấu hình electron:
Khối lượng riêng []: 2,07
Trạng thái: Rắn
Nhiệt độ nóng chảy [°C]: 112,8
Nhiệt độ sôi [°C]: 444,674
Điểm tới hạn [°C]: 1040
Áp suất tới hạn [MPa]: 20,7
Bán kính nguyên tử [pm]: 88
Bán kính cộng hóa trị [pm]: 102
Độ dẫn điện []: 0,269
Nhiệt dung riêng []: 0,71
Độ cứng (Theo thang Mohs): 2,0
Điện dẫn suất []:
Năng lượng ion hóa bậc 1 [eV]: 10,36
Năng lượng ion hóa bậc 2 [eV]: 23,33
Năng lượng ion hóa bậc 3 [eV]: 34,83
Đồng vị bền: 4
Đồng vị không bền: 6
Nguyên tố Cl (Clo)

Ký hiệu hóa học: Cl
Tên Latin: Chlorine
Số hiệu nguyên tử: 17
Chu kỳ: 3
Nhóm nguyên tố: Halogen
Nguyên tử khối tương đối: 35,4527
Nhóm: VIIA
Độ âm điện: 3,0
Số oxi hóa: -1, +1, +3, +4, +5, +6, +7
Cấu hình electron:
Khối lượng riêng []: 0,003214
Trạng thái: Khí
Nhiệt độ nóng chảy [°C]: -100,98
Nhiệt độ sôi [°C]: -34,6
Điểm tới hạn [°C]: 143,75
Áp suất tới hạn [MPa]: 7,991
Bán kính nguyên tử [pm]: 42
Bán kính cộng hóa trị [pm]: 71
Độ dẫn điện []: 0,0089
Nhiệt dung riêng []: 0,48
Thời điểm khám phá: Năm 1774
Năng lượng ion hóa bậc 1 [eV]: 12,9676
Năng lượng ion hóa bậc 2 [eV]: 23,81
Năng lượng ion hóa bậc 3 [eV]: 39,611
Đồng vị bền: 2
Đồng vị không bền: 9
Nguyên tố Ar (Argon)
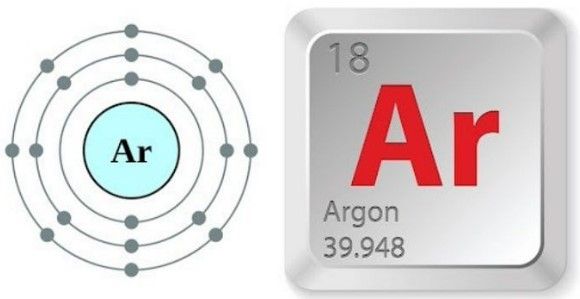
Ký hiệu hóa học: Ar
Tên Latin: Argon
Số hiệu nguyên tử: 18
Chu kỳ: 3
Nhóm nguyên tố: Khí hiếm
Nguyên tử khối tương đối: 39,948
Nhóm: VIIIA
Cấu hình electron:
Khối lượng riêng []: 0,0017838
Trạng thái: Khí
Nhiệt độ nóng chảy [°C]: -189,4
Nhiệt độ sôi [°C]: -185,87
Điểm tới hạn [°C]: -86,28
Áp suất tới hạn [MPa]: 4,988
Bán kính nguyên tử [pm]: 71
Bán kính cộng hóa trị [pm]: 97
Độ dẫn điện []: 0,0177
Nhiệt dung riêng []: 0,52
Thời điểm khám phá: Năm 1894
Năng lượng ion hóa bậc 1 [eV]:15,7596
Năng lượng ion hóa bậc 2 [eV]: 27,629
Năng lượng ion hóa bậc 3 [eV]: 40,74
Đồng vị bền: 3
Đồng vị không bền: 5
Như vậy, Số nguyên tố trong chu kì 3 của bảng tuần hoàn các nguyên tố hóa học là 8 nguyên tố hóa học. Hy vọng với chia sẻ hữu ích từ Admin FQA trong bài viết này sẽ giúp các em nắm rõ về các nguyên tố thuộc chu kì 3 trong bảng tuần hoàn hóa học.



















![Top 15 trường THPT tư thục tốt nhất TPHCM [Cập nhật mới 2023]](https://static.fqa.vn/fqa/sgk/top_truong_thpt_tu_thuc_tot_nhat_tphcm_be9958a086.jpg)




